Tổng hợp các công thức hóa học lớp 8 chi tiết
Để học tốt Hóa 8, các em phải nắm vững kiến thức và các công thức có trong chương trình học. Bài viết tiếp theo của interconex sẽ giúp các bạn Tổng hợp các công thức hóa học lớp 8 chi tiết !

Các công thức hóa học lớp 8 cần nhớ
Chương trình hóa học lớp 8 dựa trên kiến thức của bạn về vật chất, nguyên tử, phương trình hóa học và hơn thế nữa. Bài viết này của interconex sẽ giúp các bạn tổng hợp công thức lớp 8 đầy đủ nhất!

Công thức tính số Mol
Công thức tính số mol là:
![]()
Ở đó:
- m: khối lượng (tính bằng gam).
- M: khối lượng mol tính bằng g / mol.

Công thức này áp dụng cho số mol khí ở điều kiện tiêu chuẩn.
Ở đó:
- V: Thể tích khí ở điều kiện tiêu chuẩn tính bằng lít.

Công thức này áp dụng cho khung máy bay.
Ở đó:
- P: áp suất (đơn vị: atm)
- V: Thể tích (đơn vị: lít)
- R: hằng số (R = 0,082)
- T: Nhiệt độ Kelvin (T = oC + 273)

Ở đó:
- CM: nồng độ dung dịch tính bằng mol / lít.
- Vdd: Thể tích dung dịch tính bằng lít.

Ở đó:
- N: số nguyên tử hoặc phân tử.
- NA: Avogadro (NA = 6,02.1023).

Công thức tính nồng độ dung dịch
Để tính nồng độ dung dịch / nồng độ mol của một dung dịch, ta có công thức sau:
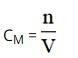
Ở đó:
- n: số mol chất tan (đơn vị: mol).
- V: Thể tích dung dịch tính bằng lít.
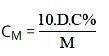
Ở đó:
- D: Tỷ trọng (đơn vị: g / ml)
- C%: Phần trăm nồng độ (đơn vị: C%)
- M: khối lượng mol (đơn vị: g / mol)
Công thức tính tỉ khối
- Công thức tính khối lượng riêng của khí A và khí B:
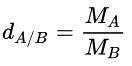
- Công thức tính khối lượng riêng của khí A với không khí:
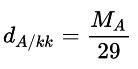
Ở đó:
- D là mật độ.
- con ma; MB lần lượt là khối lượng mol của khí A và khí B, tính bằng g / mol.

Công thức tính thể tích
- Thể tích của khí ở điều kiện tiêu chuẩn:
V = nx 22,4
- Khối lượng chất rắn và chất lỏng:
![]()
- Khối lượng trong các điều kiện không tiêu chuẩn:
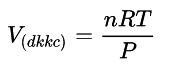
Ở đó:
- P: áp suất (atm)
- R: hằng số (22,4: 273)
- T: nhiệt độ: ok (oC + 273)
Tính thành phần phần trăm về khối lượng của mỗi nguyên tố trong hợp chất
Giả sử hỗn hợp A và B gồm hai chất.

Ở đó:
- Tốt; con ma; mB lần lượt là khối lượng hỗn hợp, khối lượng chất A và khối lượng chất B tính bằng gam.
Tính nồng độ phần trăm
Công thức tính nồng độ phần trăm là một trong những công thức mà các em nên học thuộc môn hóa lớp 8. Do đó, ta tính nồng độ phần trăm của một chất theo công thức:
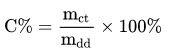
Ở đó:
- mct là khối lượng của chất tan.
- mdd là khối lượng của dung dịch.
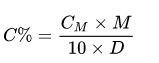
Ở đó:
- CM: nồng độ mol (mol / lít)
- D: Mật độ (g / ml)
- M: khối lượng mol (g / mol)

Độ tan
Công thức tính độ tan là:
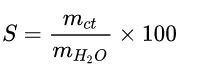
Ở đó:
mct: khối lượng của chất tan.
Cách tính nguyên tử khối
Nguyên tử khối của A được tính theo công thức:
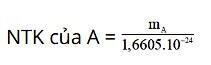
Ở đó:
- mA là khối lượng nguyên tử của A tính bằng gam.
- 1 đvC = 1u = 1,6605.10-27kg = 1,6605.10-24g.
Ví dụ:


Định luật bảo toàn khối lượng
Phản ứng: A + B → C + D
Áp dụng định luật bảo toàn khối lượng, ta được:
mA + mB = mC + mD
Ở đó:
mA, mB, mC, mD lần lượt là khối lượng của các chất A, B, C, D.
Tính hiệu suất phản ứng
Dựa trên một trong các chất phản ứng:
H% = (lượng thực tế được sử dụng để đáp ứng: tổng liều) x 100%
dựa trên một trong những thành phần
H% = (lợi nhuận thực tế: lợi nhuận lý thuyết) x 100%
Các dạng bài tập Hóa học cơ bản lớp 8 – SBT, SGK
Để nắm vững các công thức hóa học lớp 8, hãy cùng interconex luyện tập các dạng bài tập cơ bản có trong SBT và SGK nhé!
Công thức Hóa học và tính theo công thức Hóa học
1. Lập công thức hóa học của hợp chất khi biết hóa trị của nó.
Các bước để xác định hóa trị là:
Bước 1: Viết AxBy. chính thức
Bước 2: Lập phương trình: hóa trị x của A = hóa trị của y × B.
Bước 3: Chuyển đổi sang tỷ lệ: 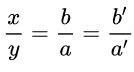
= hóa trị của B / hóa trị của A
Chọn a ‘, b’ là các số nguyên dương và chọn tỉ số b ‘/ a’ là nhỏ nhất → x = b (hoặc b ‘); y = a (hoặc a ‘)
2. Tính thành phần% theo khối lượng của các nguyên tố trong hợp chất A x B y C z .
Phương pháp 1:
- Tìm khối lượng mol của hợp chất.
- Tìm số mol của mỗi nguyên tố trong 1 mol hợp chất và quy đổi về khối lượng.
- Tìm tỉ lệ các nguyên tố trong hợp chất.
Cách 2: Xét Công thức A x B y C z
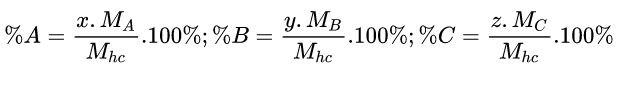 % C có thể được tính bằng công thức: % C = 100% – (% A +% B)
% C có thể được tính bằng công thức: % C = 100% – (% A +% B)
3. Khi tỉ lệ thành phần (%) là khối lượng, hãy lập công thức hoá học của hợp chất.
Xác định công thức hóa học của hợp chất:
- Bước 1: Tìm khối lượng của từng nguyên tố trong 1 mol hợp chất.
- Bước 2: Tìm số mol nguyên tử của nguyên tố trong 1 mol hợp chất.
- Bước 3: Lập công thức hóa học cho hợp chất.
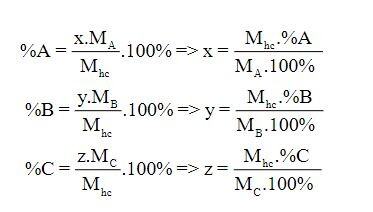
4. Lập công thức hóa học dựa trên tỉ lệ khối lượng của các nguyên tố.
Bài tập tổng hợp:
Xét một hợp chất gồm hai nguyên tố A và B có tỉ lệ khối lượng là a: b.
có
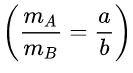
Tìm công thức của hợp chất.
Để công thức tổng quát của hai nguyên tố có dạng AxBy. (Ở đây ta cần tìm x, y của A, B. Tìm tỉ số: x: y → x, y).
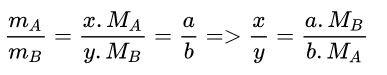
→ công thức hóa học

Phương trình Hóa học & tính theo phương trình Hóa học
1. Công thức phản ứng hóa học
tất cả. phương trình hóa học cân bằng
a) CuO + H2 → Cu + H2O
b) CO2 + NaOH → Na2CO3 + H2O
c) Zn + HCl → ZnCl2 + H2
d) Al + O2 → Al2O3
e) NaOH + CuSO4 → Cu (OH) 2 + Na2SO4
f) Al2O3 + NaOH → NaAlO2 + H2O
g) Fe (OH) 3 → Fe2O3 + H2O
h) H3PO4 + Ca (OH) 2 → Ca3 (PO4) 2 + H2O
i) BaCl2 + AgNO3 → AgCl + Ba (NO3) 2
k) FeO + H2SO4 → Fe2 (SO4) 3 + SO2 + H2O
Lời giải chi tiết:
a) CuO + H2 → Cu + H2O
b) CO2 + 2NaOH → Na2CO3 + H2O
c) Zn + 2HCl → ZnCl2 + H2
d) 4Al + 3O2 → 2Al2O3
e) 2NaOH + CuSO4 → Cu (OH) 2 + Na2SO4
f) Al2O3 + 2NaOH → 2NaAlO2 + H2O
g) 2Fe (OH) 3 → Fe2O3 +3 H2O
h) 2H3PO4 + 3Ca (OH) 2 → Ca3 (PO4) 2 + 3H2O
i) BaCl2 + 2AgNO3 → 2AgCl + Ba (NO3) 2
k) 2FeO + 4H2SO4 → Fe2 (SO4) 3 + SO2 + 4H2O
Hoàn thành phương trình hóa học sau.
1) Phốt pho + Khí oxi → Phốt pho (V) oxit (P2O5)
2) Khí hiđro + oxit sắt từ (Fe3O4) → sắt + nước
3) Kẽm + axit clohydric → kẽm clorua + hydro
4) Canxi cacbonat + axit clohydric → canxi clorua + nước + cacbon đioxit
5) sắt + đồng (II) sunfat → sắt (II) sunfat + đồng
Lời giải chi tiết:
1) Phốt pho + Khí oxi → Phốt pho (V) oxit (P2O5)
2P + 5O2 → P2O5
2) Khí hiđro + oxit sắt từ (Fe3O4) → sắt + nước
4H2 + Fe3O4 → 3Fe + 4H2O
3) Kẽm + axit clohydric → kẽm clorua + hydro
Zn + 2HCl → ZnCl2 + H2
4) Canxi cacbonat + axit clohydric → canxi clorua + nước + cacbon đioxit
CaCO3 + 2HCl → CaCl2 + H2O + CO2
5) sắt + đồng (II) sunfat → sắt (II) sunfat + đồng
Fe + CuSO4 → FeSO4 + Cu
Hạt giống. Hãy chọn phương trình hóa học đúng cho dấu hỏi và cân bằng các phương trình hóa học sau.
1) CaO + HCl → ? + H2
2) P +? → P2O5
3) Na2O + H2O →?
4) Ba (NO3) 2 + H2SO4 → BaSO4 +?
5) Ca (HCO3) 2 → CaCO3 + CO2 +?
6) CaCO3 + HCl → CaCl2 +? + H2O
7) NaOH +? → Na2CO3 + H2O
Lời giải chi tiết:
1) CaO + 2HCl → CaCl2+ H2
2) 4P + 5O2 → 2P2O5
3) Na2O + H2O → 2NaOH
4) Ba (NO3) 2 + H2SO4 → BaSO4 + 2HNO3
5) Ca (HCO3) 2 → CaCO3 + CO2 + H2O
6) CaCO3 + 2HCl → CaCl2 + CO2 + H2O
7) 2NaOH + CO2 → Na2CO3 + H2O
D. Cân bằng các phương trình hóa học sau có chứa
1) FexOy + H2 → Fe + H2O
2) FexOy + HCl → FeCl2y/x + H2O
3) FexOy + H2SO4 → Fe2(SO4)2y/x + H2O
4) M + H2SO4 → M2 (SO4) n + SO2 + H2O
5) M + HNO3 → M (NO3) n + NO + H2O
6) FexOy + H2SO4 → Fe2 (SO4) 2y / x + SO2 + H2O
vết thương:
1) FexOy + H2 → Fe + H2O
2) FexOy + HCl 2y → x FeCl2y / x + y H2O
3) 2FexOy + (6x – 2y) H2SO4 → xFe2 (SO4) 3 + (3x – 2y) SO2 + (6x – 2y) H2O
4) 2FexOy + (6x – 2y) H2SO4 → xFe2 (SO4) 3 + (3x – 2y) SO2 + (6x – 2y) H2O
5) (5x – 2y) M + (6nx – 2ny) HNO3 → (5x – 2y) M (NO3) n + nNxOy + (3nx – ny) H2O
6) FexOy + 2y H2SO4 → x Fe2(SO4)2y/x + 2y H2O

2. Tính theo phương trình hóa học
Để làm tốt bài thi này, các em cần học thuộc các công thức cấu tạo môn hóa học lớp 8 sau đây.
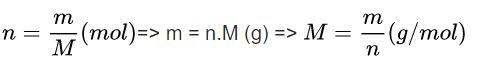
Ở đó:
- n: số mol chất (mol)
- m: khối lượng (gam)
- M: khối lượng mol (gam / mol)
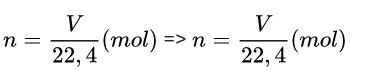
Ở đó:
- V: Thể tích chất (điều kiện tiêu chuẩn) tính bằng lít
3. Vấn đề dư
Giả sử có phản ứng hóa học: aA + bB → cC + dD.
Gọi nA là số mol chất A, gọi nB là số mol chất B.
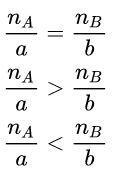
→ A và B là hai chất phản ứng (vừa đủ)
→ Sau phản ứng, A còn lại và B hết phản ứng
→ Sau phản ứng, A phản ứng hoàn toàn và B còn lại
Tính khối lượng chất dựa trên tổng các chất phản ứng.
Ví dụ: cho 6,5 g kẽm phản ứng với 36,5 g dung dịch HCl. Tính khối lượng muối tạo thành sau phản ứng.
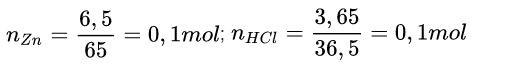
Zn + 2HCl → ZnCl2 + H2
Theo phương trình: 1 mol 2 mol 1 mol
Theo tiêu đề: 0,1 mol 0,1 mol 0,05 mol
Hãy xem xét tỷ lệ.
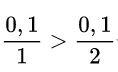
→ Zn dư, khối lượng HCl
![]()
Dung dịch và nồng độ dung dịch
1. Các công thức cần ghi nhớ
Độ hòa tan
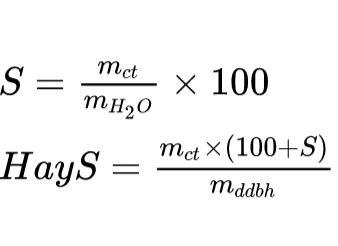
Nồng độ dung dịch (C%)
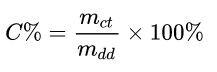
Ở đó:
- mct: khối lượng chất tan (g)
- mdd: khối lượng dung dịch (g)
Ví dụ: Hòa tan 15 g muối vào 50 g nước. Tính nồng độ phần trăm của dung dịch tạo thành.
Lời giải chi tiết:
mdd = mdm + mct = 50 + 15 = 65g
Ứng dụng chính thức:
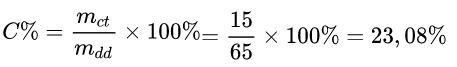
Hạt giống. Nồng độ mol của dung dịch (CM)
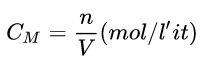
Ví dụ: Tính nồng độ mol của một dung dịch khi 0,5 lít dung dịch CuSO4 chứa 100 g CuSO4.
Lời giải chi tiết:
Nồng độ mol của CuSO4 = 100: 160 = 0,625 mol
Số mol dung dịch CuSO4 = 0,625: 0,5 = 1,25M
D. Công thức liên hệ giữa D (khối lượng riêng), mdd (khối lượng dung dịch) và Vdd (thể tích dung dịch):
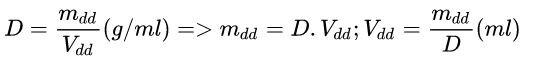

Dưới đây là một số bài tập cơ bản. Xin vui lòng tham khảo!
Dạng 1: Chuyển động hòa tan
Bài tập 1: Hòa tan 60 g KNO3 trong 190 g nước ở 20oC, thu được dung dịch bão hòa. Tính độ tan của KNO3 ở nhiệt độ đó?
trả lời:
Cho 190 g H2O thì 60 g KNO3 tan hết tạo thành dung dịch bão hoà.
100 g H2O hòa tan được x gam KNO3.
SKNO3 = (100,60) / 190 = 31,58.
Bài tập 2: Độ tan của K2SO4 ở 20oC là 11,1g. Phải hoà tan bao nhiêu gam muối này vào 80 g nước để được dung dịch bão hoà ở nhiệt độ nhất định?
trả lời:
20oC: 100g nước hòa tan được tối đa 11,1g K2SO4.
Vì vậy, tối đa 80 g nước hòa tan là:
Số gam muối cần hòa tan: (80.11,1) / 100 = 8,88 gam.
Bài tập 3: Tính khối lượng KCl kết tinh sau khi làm lạnh 600 g dung dịch bão hoà từ 80oC xuống 20oC. Độ tan của S là 51 g ở 80oC và 34g ở 20oC.
trả lời:
Độ tan của KCl ở 80oC là 51 g.
151 g dung dịch bão hòa chứa 51 g KCl.
604 giác quan → 204 giác quan
Gọi khối lượng KCl tách ra là gam.
Độ tan của KCl ở 20oC là 34g.
134 g dung dịch bão hòa chứa 34 g KCl.
604 – Trò chơi 204 – Trò chơi
⇒ 34. (604 – a) = 134. (204 – a) ⇒ a = 68
Do đó khối lượng KCl kết tinh là 68 g.
Dạng 2: Hỗn hợp dung dịch trong đó xảy ra phản ứng giữa chất tan hoặc chất tan và dung môi → Phải tính nồng độ của sản phẩm (không tính nồng độ của chất tan).
Ví dụ: Na2O, CaO, SO3,… trong nước. , phản ứng sau xảy ra:
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
Bài tập 1: Cho 6,2 g Na2O vào 73,8 g nước thu được dung dịch A. Tính nồng độ của một chất trong dung dịch A?
trả lời:
nNa2O = 6,2 / 62 = 0,1 mol
công thức hóa học
Na2O + H2O → 2NaOH
0,1 → 0,2 (mol)
mNaOH = 0,2.40 = 8 phép trừ
mdd A = mNa2O + nước m = 6,2 + 73,8 = 80 g
→ C% NaOH (dd A) = 8/80 .100% = 10%
Bài tập 2: Cho 6,2 g Na2O vào 133,8 g dung dịch NaOH 44,84%. Tính nồng độ của một chất trong dung dịch dưới dạng phần trăm?
trả lời:
nNa2O = 6,2 / 62 = 0,1 mol
công thức hóa học
Na2O + H2O → 2NaOH
⇒ nNaOH tạo ra = 0,1.2 = 0,2 mol
nNaOH = (133,8.44,84) / (100,40) = 1,5 mol
⇒nNaOH = 1,5 + 0,2 = 1,7 mol
Theo định luật bảo toàn khối lượng: mNa2O + mdd NaOH = mdd spu = 6,2 + 133,8 = 140 g
⇒ C% dd = (1,7.40) / 140⋅100% = 48,6%

Bài viết trên đây của interconex đã tổng hợp công thức hóa học lớp 8 chi tiết và đầy đủ nhất. Chúng tôi hy vọng nó sẽ giúp ích cho bạn trong quá trình học tập của mình. Hẹn gặp lại các bạn trong những bài viết tiếp theo!